エクソソームを含む細胞外小胞(EV)精製キット『EXORPTION®』

*本キットは研究用試薬のため、医療従事者・研究者を販売対象としています。
三洋化成の細胞外小胞(EV)精製キット
『EXORPTION®』はここがすごい
1
簡便な操作で細胞外小胞(EV)の精製が90分以内で完了
当社が開発した『EXORPTION®』は簡便な操作により、わずか 90分で高純度の細胞外小胞(EV)を高回収率に得ることを可能にした精製キットです。生体由来試料を吸収する特殊なハイドロゲルビーズの入ったスピンカラムを用いており、一般的な小型卓上遠心機で精製処理することが可能で、専用装置は不要です。現在普及している超遠心法と比較して約 1/20の90分で精製でき、夾雑物(きょうざつぶつ/測定対象以外の混合物)量が約1/100 未満の高純度な細胞外小胞(EV)を、約10倍近い回収量で得られます。
2
超遠心法(UC)、他社キットと比べて高い回収量と精製度の両立を達成
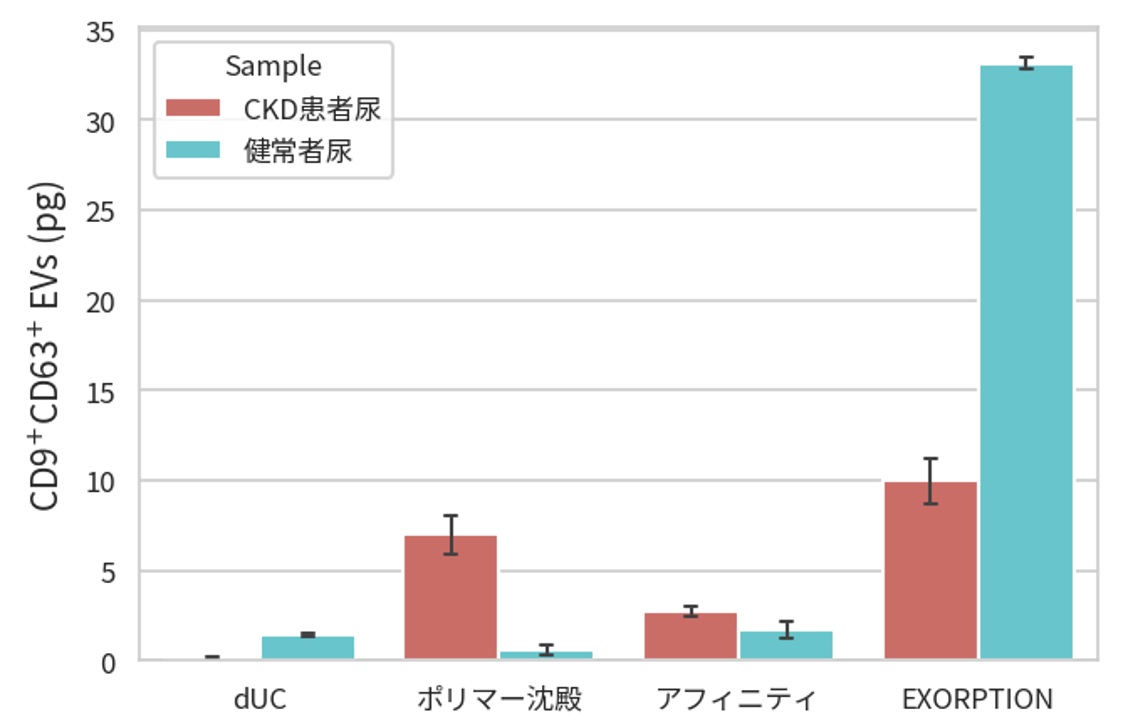
本方法の最大の特長は検体あたりの細胞外小胞(EV)回収量にあり、ゴールドスタンダードの超遠心法と比較して10倍以上の回収率を示します(下図)。
この特長は体液中に極微量に含まれる細胞外小胞(EV)を高感度に検出することに貢献しますが、それだけでなく、創薬においても治療に用いる細胞外小胞(EV)を大量に得るために有用な技術となります。また、一部のアフィニティ精製法と異なり、最終精製物に余分な化学物質を含まないことや細胞外小胞(EV)の脂質二重膜構造の破壊がない点なども創薬においては大きなメリットとなります。
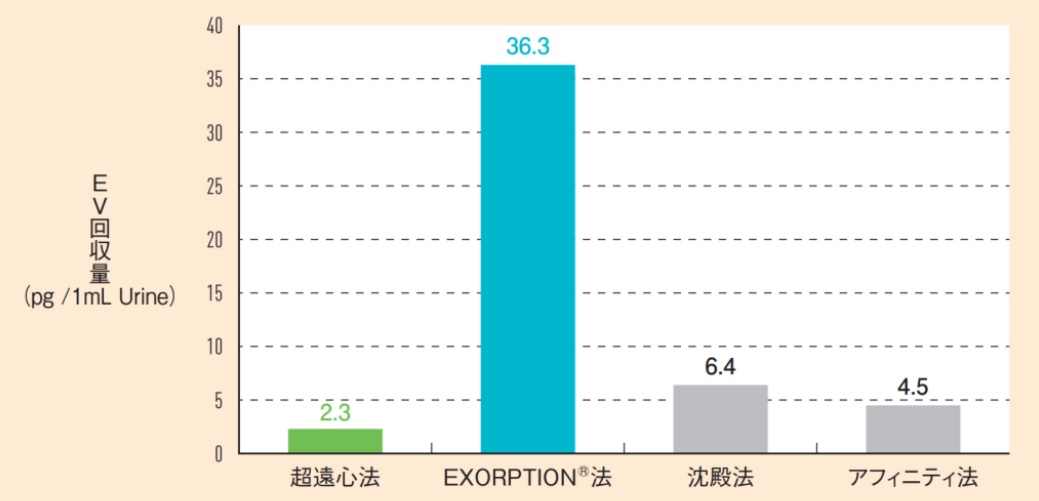
図 細胞外小胞(EV)の回収量(CD9/CD63 ELISA算出)
CKD(慢性腎臓病)患者尿を用いて超遠心法、HAS法および市販のキットでバイオセパレーションをした。
超遠心法は密度勾配遠心法、市販のキットは各社推奨プロトコルにて実施。
細胞外小胞(EV)回収量はCD9/CD63両陽性をELISAで定量(CD9/CD63 Exosome ELISA Kit, Human [Cat. No. EXH0102])
細胞外小胞(EV)とは
細胞外小胞(EV)は細胞が分泌する顆粒状の物質で、その表面は細胞膜由来の脂質、タンパク質を含み、内部には核酸(マイクロRNA、メッセンジャーRNA、DNAなど)やタンパク質など細胞内の物質を含んでいます(下図)。その産生経路もしくはサイズによってエクソソーム、マイクロベシクル、アポトーシス小体の3種に分別されます。しかし、これらの定義や産生経路の特定は非常に困難であり、しばしば混乱を招いていたため、2011年に設立された国際細胞外小胞学会(International Society for Extracellular Vesicles:ISEV)は、ひとくくりに「Extracellular Vesicles」と呼ぶことを推奨しています。
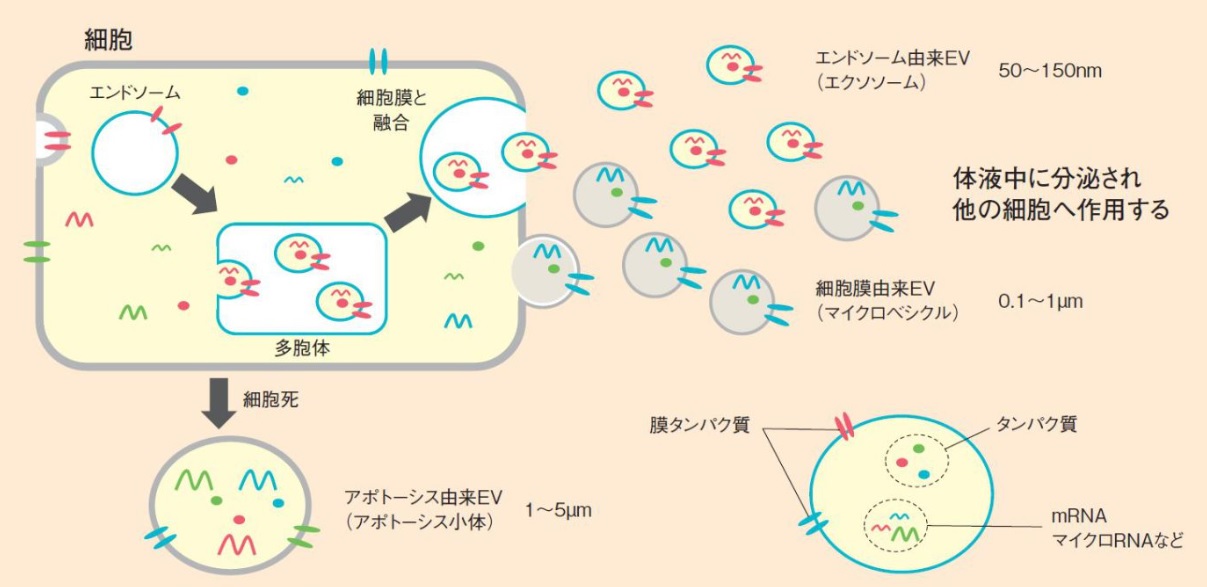
図 エクソソームを含む細胞外小胞
“細胞間のコミュニケーション”に使われる伝達物質
細胞から分泌された細胞外小胞(EV)は体液(血液、髄液、唾液、尿)に乗って体内を循環し、表面または内部の分子を巧みに利用して細胞間のコミュニケーションを行う役割を担うことがわかっています。
体内を循環している細胞外小胞(EV)を別の細胞が受け取ると、さまざまな反応を経て、疾病の進行や治療効果に関与します。例えば、がん細胞が放出する細胞外小胞(EV)は、がんの転移促進、免疫細胞の抑制、新生血管の誘導などに働くことが示されています。細胞外小胞(EV)は分泌元の細胞の情報を含んでいることから、体液中の細胞外小胞(EV)を採取して疾病の情報を解析し、超早期に病気を発見する新たな診断法が開発されています(下図)。
また、一部の細胞が放出する細胞外小胞(EV)は腎機能の改善や、炎症抑制などの治療効果をもたらすことが報告されており、治療の難しい神経変性疾患であるアルツハイマー型認知症などにも適用が検討されています。
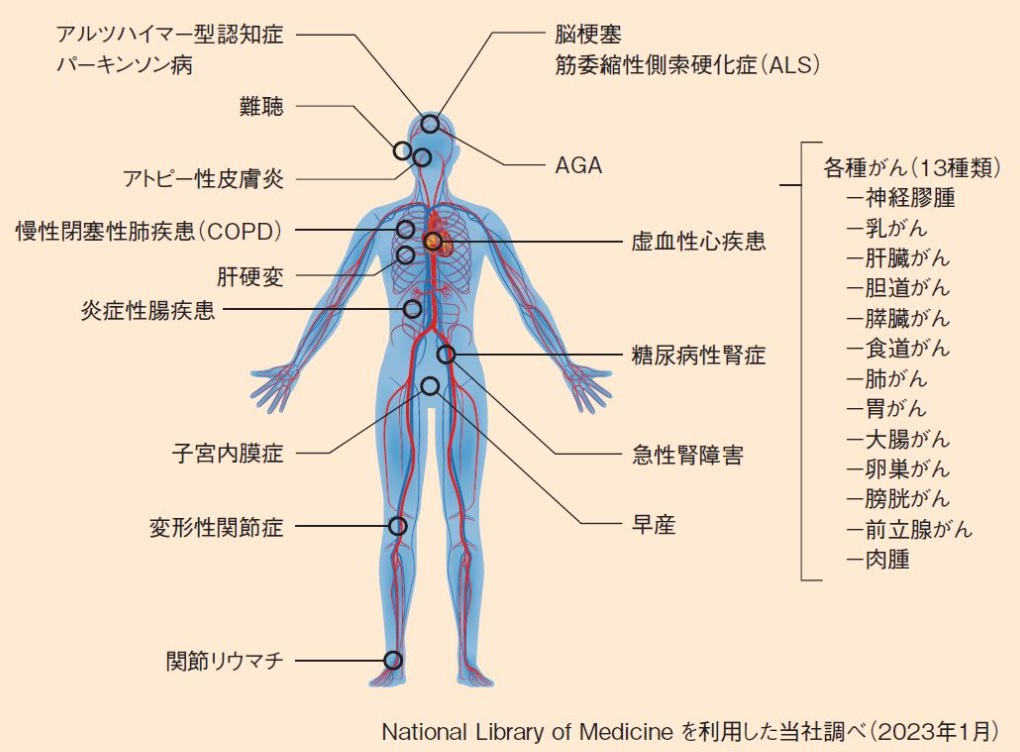
図 細胞外小胞(EV)を利用した治療・診断に関する検討事例
細胞外小胞(EV)製剤の開発における課題
産業応用のためにはバイオセパレーションの技術確立を含む以下の4つの課題解決が必要となります。
| 技術課題 | 原料の選択 細胞外小胞(EV)の原料となる細胞の種類、品質管理、培養法、培地、培養を介さないケースへの対応など課題が多い 細胞外小胞(EV)精製法 多検体・多量処理、不純物の混入、サイズの分画、有効成分を含まない細胞外小胞(EV)の除去などを解決する精製法が必要 |
|---|---|
| 有効性 ・ 安全性 |
安全性 細胞外小胞(EV)そのものの安全性、感染性物質やエンドトキシン、培地成分のコンタミ防止などの品質管理手法の構築が必要 有効成分および投与量の規定 有効成分ないし作用機序、有効成分量の明確化、有効性に関する評価系の確立など有効性の担保と、体内に投与する際の投与単位と測定方法の明確化が求められる |
細胞外小胞(EV)のバイオセパレーション
バイオセパレーションは生体由来試料より細胞・タンパク質・核酸などの生体物質を選択的に分離する技術を指し、診断においては疾患の検査感度に直結し、治療においては薬効、副作用に影響する創薬のコアとも呼べる重要技術です。現在、細胞外小胞(EV)のバイオセパレーション方法としては超遠心分離機を利用した手法がゴールドスタンダードとされています。
一般的な超遠心分離のイメージは目標物が分離機の底にたまって回収できるイメージですが、この方法で細胞外小胞(EV)を高純度で得る場合は、液体中に試料を投入し、遠心分離後の特定の高さに現れる層を吸い出して回収するという非常に繊細な手技が必要になります。この複雑かつ長時間の操作で回収率は20%に満たないというのが細胞外小胞(EV)特有の難しさであり、細胞外小胞(EV)の実用化においてバイオセパレーションが壁といわれるゆえんです。上記の課題解決に対するニーズは大きく、超遠心法に比較して簡易な操作でバイオセパレーションできる研究試薬が上市されています。
バイオセパレーション方法の比較
超遠心法に比較して簡易な操作でバイオセパレーションできる研究試薬も含め、精製法比較を行いました(下表)。
| 原理 | 処理時間・工数 | 性能的特徴 | |
|---|---|---|---|
| 超遠心法 | 遠心力を用いて細胞外小胞(EV)を一定の分画に分離して回収する方法。 ペレットダウン法や密度勾配遠心法などがある。 | 1~3日 | 細胞外小胞(EV)研究のゴールドスタンダードになっている。 回収効率や精製度は高くなく、手技による影響も大きい。 容器以外に接触する素材がないので、試薬などの影響を考慮しなくてよい。 |
| フィルター法 | 限外濾過フィルターなどを用いて夾雑物と細胞外小胞(EV)を分離する方法 | 30~120分 | 操作は簡単で、手技的な要素も少ない。 フィルターを組み合わせることで細かくサイズを分けることができるが、膜状に細胞外小胞(EV)が吸着してロスが大きく、精製度も高くなりにくい。 |
| 沈殿法 | 細胞外小胞(EV)を含む生体試料にポリマー溶液を加えて、細胞外小胞(EV)を沈殿させることで濃縮分離する方法 | 30~120分 | 操作は簡単で、短時間に細胞外小胞(EV)を得ることができる。 ただし細胞外小胞(EV)と一緒に沈殿してくる夾雑物もあり、精製度は高くなりにくい。 また最終精製物に試薬が混入する。 |
| アフィニティ法 | 抗体などを結合させた固定化担体へ細胞外小胞(EV)を結合させ、夾雑物を洗い流した後に結合を外して回収する方法 | 数時間 | 親和性を利用して夾雑物と分離するため、一般に精製度は高い。 固定化担体を操作して分離するため、スケールアップが難しい。 また、細胞外小胞(EV)を結合させる方式によっては最終精製物に試薬が混入する。 |
| HAS法 | 細胞外小胞(EV)を含む生体試料にハイドロゲルビーズを接触させ、ビーズ表面に細胞外小胞(EV)を補足するとともに夾雑物を分離(低分子夾雑物はビーズ内部、高分子夾雑物はビーズ外部)し、表面の細胞外小胞(EV)を回収する方法 | 70~90分 | 短時間、高収率で精製度の高い細胞外小胞(EV)を得ることができる。 操作も簡便であるため、手技的な要素も少ない。 |
Hydrogel Adsorption Separation (HAS)法
Hydrogel Adsorption Separation (HAS)法は、ハイドロゲルの表面への細胞外小胞(EV)吸着を利用したEVセパレーション技術です。
EXORPTION® -HAS法による細胞外小胞(EV)精製キット
・検体の処理が完了する時間 約 1/10
・検体1mL当たりの細胞外小胞(EV)回収率 約10倍
・検体に含まれる 雑物量 約1/100
(密度勾配超遠心法と比較)
HAS法-細胞外小胞(EV)精製原理-
当社は、国立大学法人徳島大学大学院医歯薬学研究部保健学域生体機能解析学分野冨永辰也教授、および同大学院社会産業理工学研究部理工学域右手浩一教授らの研究グループと共同で、ハイドロゲルビーズを用いてさまざまな体液から細胞外小胞(EV)を高効率・高収率・高精製度に回収する新規なバイオセパレーション方法「Hydrogel Adsorption Separation(HAS)法」を開発しました。
当社はこれまで尿や血液などの体液を効率よく処理する技術を開発してきました。体外診断用医薬品の事業では夾雑物の多い体液から目的生体分子を取り出すバイオセパレーション用磁気ビーズを製品化し、多くのノウハウを蓄積しています。これらの経験と界面制御技術を駆使することで、従来のバイオセパレーション方法の課題を解決するユニークな原理を「HAS法」として具現化することに成功しました。
「HAS法」による細胞外小胞(EV)の精製について概略を下図に示します。本方法は血液、尿、細胞培養液などの生体由来試料とハイドロゲルビーズを接触させるところから始まります。ビーズは生体由来試料を吸収するよう設計しており、30分程度でビーズが膨潤します。微視的に見るとビーズ表面は網目のようになっており、吸収の過程で液体が網目を抜けてビーズ内に移動することで①低分子夾雑物、②細胞外小胞(EV)、③高分子夾雑物の分離が起こります。低分子夾雑物は網目の中を通り抜けビーズ中に吸収されます。細胞外小胞(EV)はビーズ表面が細胞外小胞(EV)親和成分で覆われているため網目に捕捉されます。高分子夾雑物はビーズ表面と強く相互作用しないため、次の洗浄工程にて洗い流されます。特に高分子夾雑物は検体のpHによって立体構造(コンホメーション)やゼータ電位が変化するため、検体の個体差によって精製度が変化することがありますが、本方法はビーズがバッファー効果を有しており、検体は一定のpHに収束するため、精製度のバラつきが少なくなります。
次工程でビーズに吸着した細胞外小胞(EV)を遊離液によって脱離することで最終精製物が得られます。実質ビーズの膨潤と細胞外小胞(EV)の遊離でバイオセパレーションが完了するので、スケールによらず90分という短時間で精製が可能となっています。
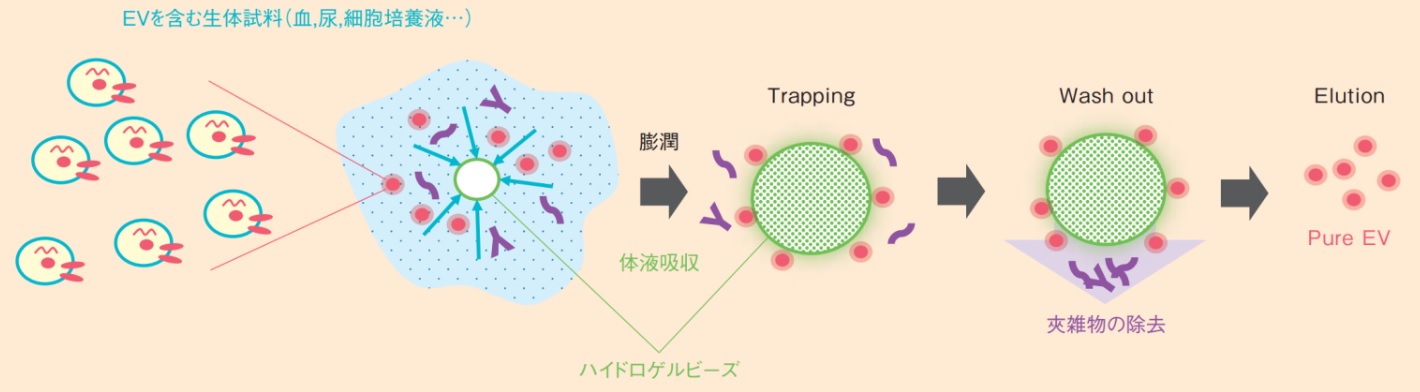
図 「HAS法」による細胞外小胞(EV)の精製
標準プロトコルの概要
ハイドロゲルビーズの入ったスピンカラムと付属のWash buffer、Elution bufferを利用します。
1.5mLマイクロチューブが利用可能な小型卓上遠心機を用いて精製が完了します。
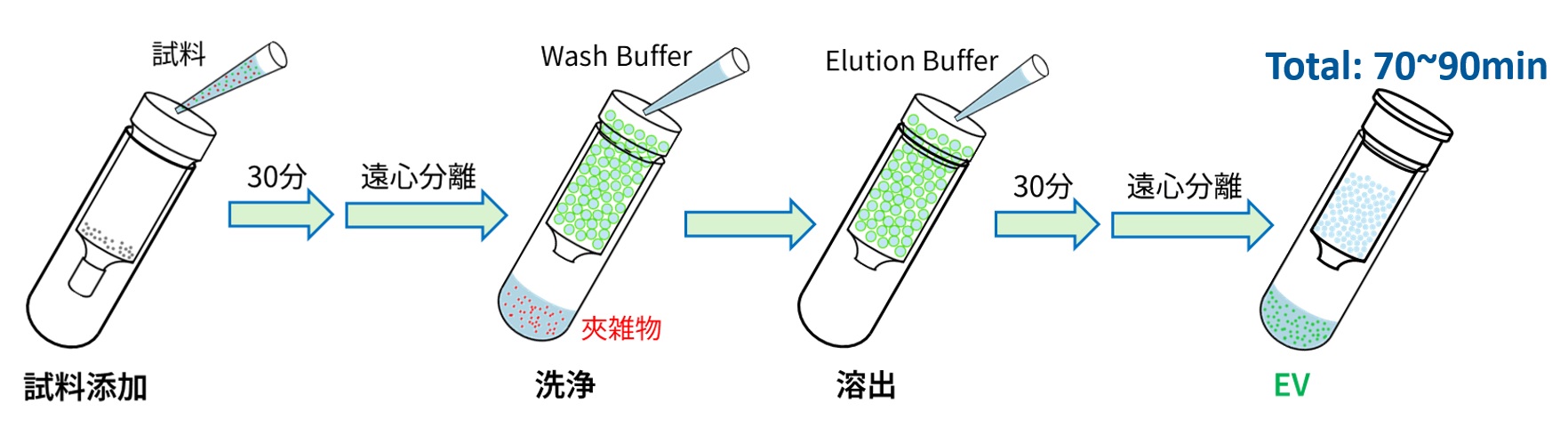
プロトコルの動画
細胞外小胞(EV)の精製法比較
本方法の最大の特長は検体あたりの細胞外小胞(EV)回収量にあり、ゴールドスタンダードの超遠心法と比較して10倍以上の回収率を示します(下図)。この特長は体液中に極微量に含まれる細胞外小胞(EV)を高感度に検出することに貢献しますが、それだけでなく、創薬においても治療に用いる細胞外小胞(EV)を大量に得るために有用な技術となります。また、一部のアフィニティ精製法と異なり、最終精製物に試薬由来の化学物質を含まないことや細胞外小胞(EV)の脂質二重膜構造の破壊がない点なども創薬においては大きなメリットとなります。
ELISA
尿検体提供:徳島大学
SDS-PAGE
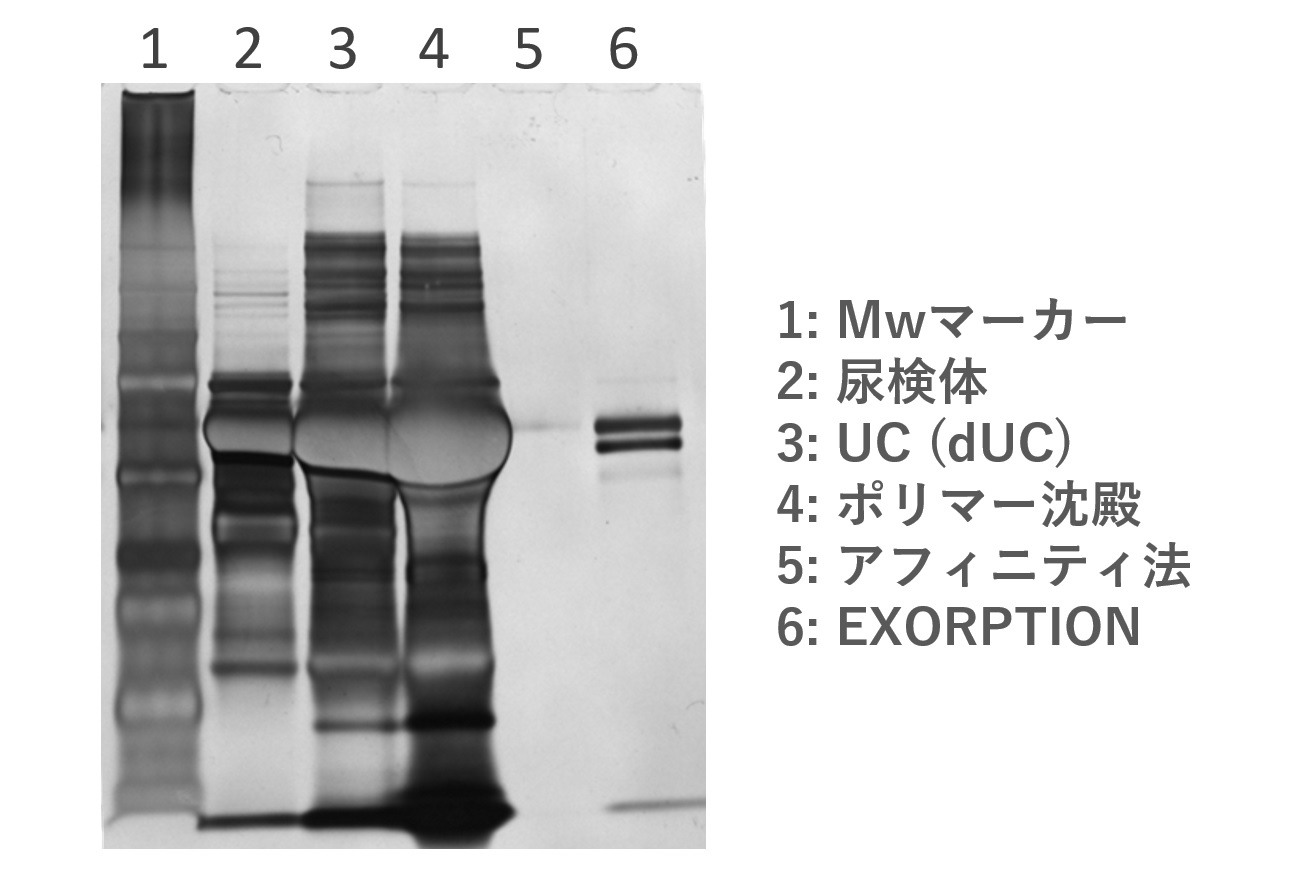
CKD(慢性腎疾患)患者尿
『EXORPTION®』を用いた各種サンプルでの
細胞外小胞(EV)の精製と分析例
EXORPTION® は細胞外小胞を簡単・迅速・高純度に精製可能な創薬研究用キットです。回収した細胞外小胞(EV)は粒子数の確認、細胞外小胞(EV)マーカー、核酸等の評価、生理活性の確認等、各種分析や実験に利用可能です。
各種サンプルから細胞外小胞(EV)の精製と分析を実施
評価サンプル:ヒト尿、ヒト血清、ヒト血漿、細胞培養上清、etc…
精製EVに対して実施した分析一覧
・ナノ粒子トラッキング解析(NTA)
・EVマーカー検出(ELISA、ウェスタンブロット)
・RNA定量、RT-qPCR
・プロテオーム解析
・シングルベシクル解析(フローサイトメーター)
EXORPTION® –ナノ粒子トラッキング解析(NTA)–
ヒト尿・血清サンプルおよびHEK293 細胞培養上清サンプルから細胞外小胞(EV)を回収し、ナノ粒子トラッキング解析(NTA)により粒子径・粒子数を評価
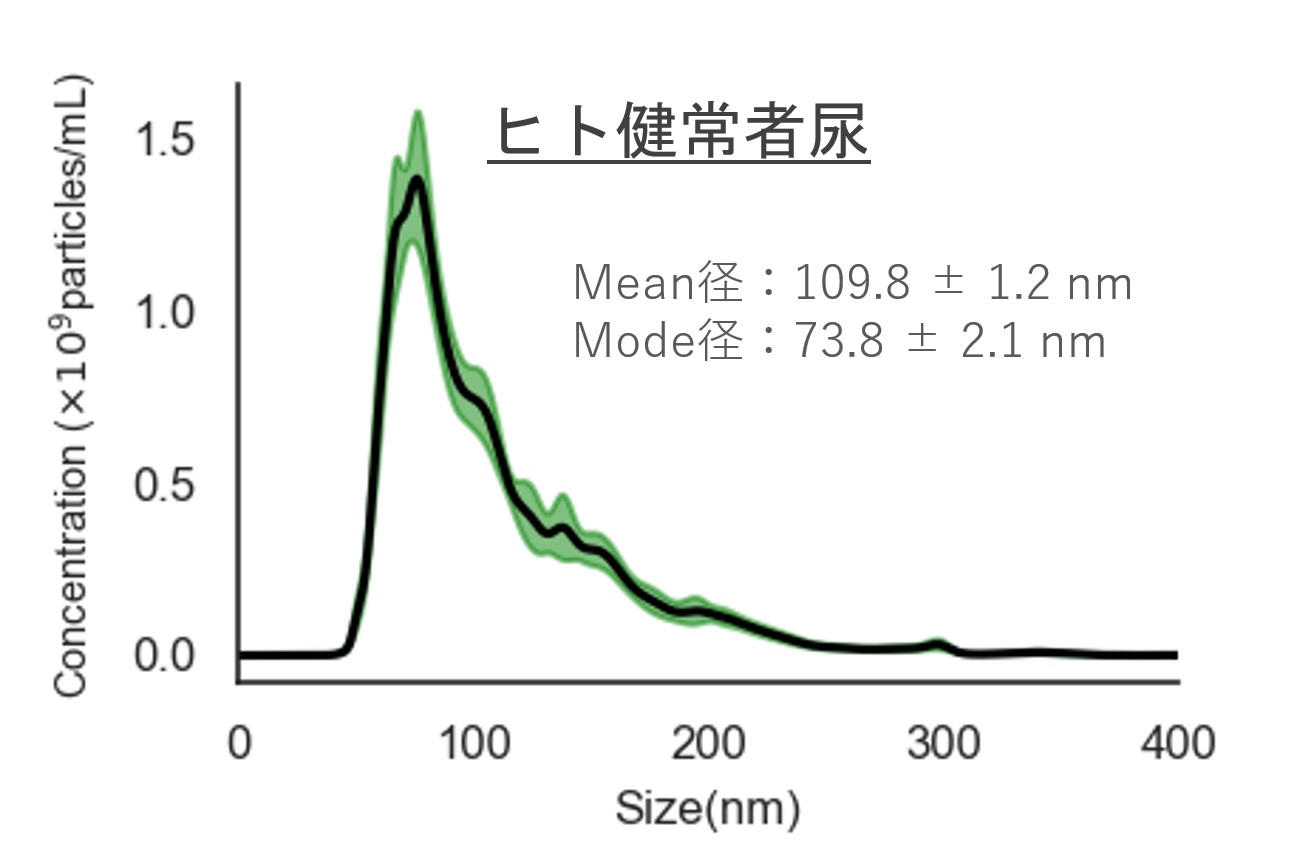
ヒト健常者尿
Mean径:109.8 ± 1.2 nm
Mode径:73.8 ± 2.1 nm
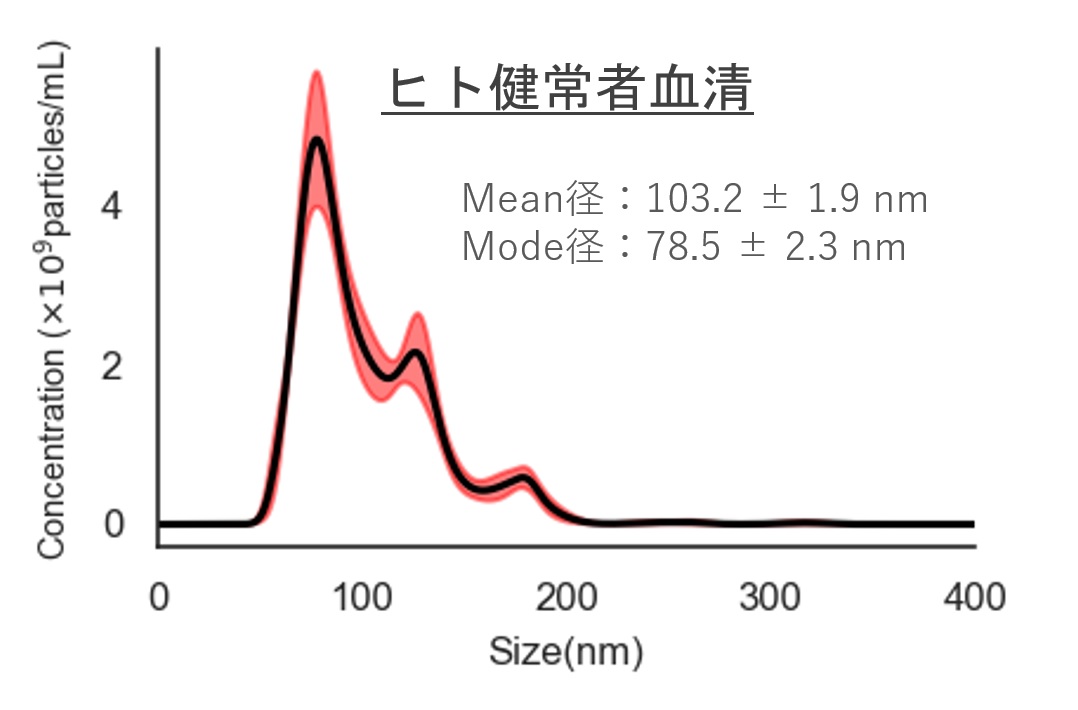
ヒト健常者血清
Mean径:103.2 ± 1.9 nm
Mode径:78.5 ± 2.3 nm
*尿・培養上清は1mLからの精製
血清・血漿は0.2mLを希釈して精製
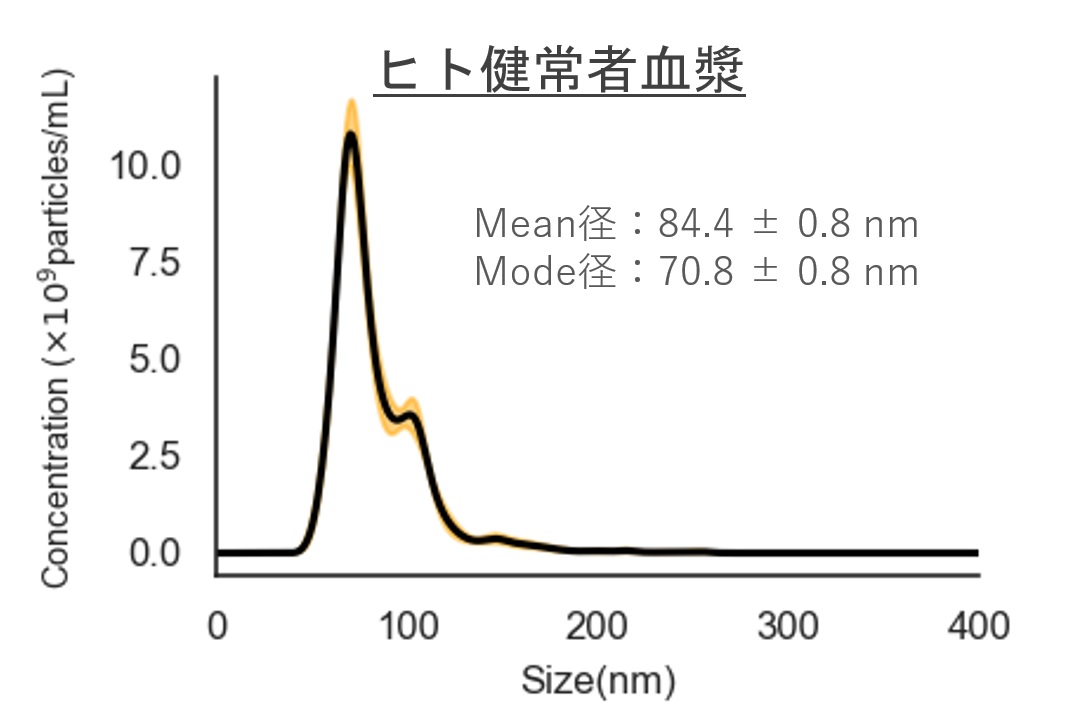
ヒト健常者血漿
Mean径:84.4 ± 0.8 nm
Mode径:70.8 ± 0.8 nm
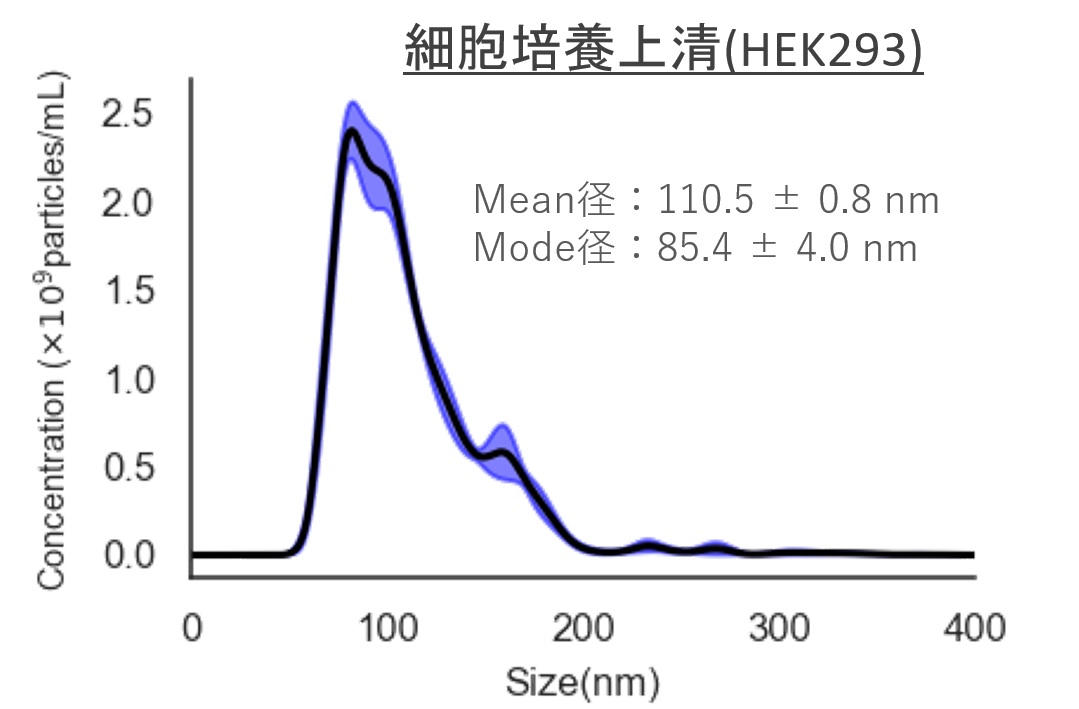
細胞培養上清(HEK293)
Mean径:110.5 ± 0.8 nm
Mode径:85.4 ± 4.0 nm
EXORPTION® –各検体からの細胞外小胞(EV)精製–
各検体中の細胞外小胞(EV)マーカーを確認 → 検体によらず細胞外小胞(EV)マーカーの検出に成功
ELISA (CD9/CD63)によるCD9+/CD63+ EVの定量
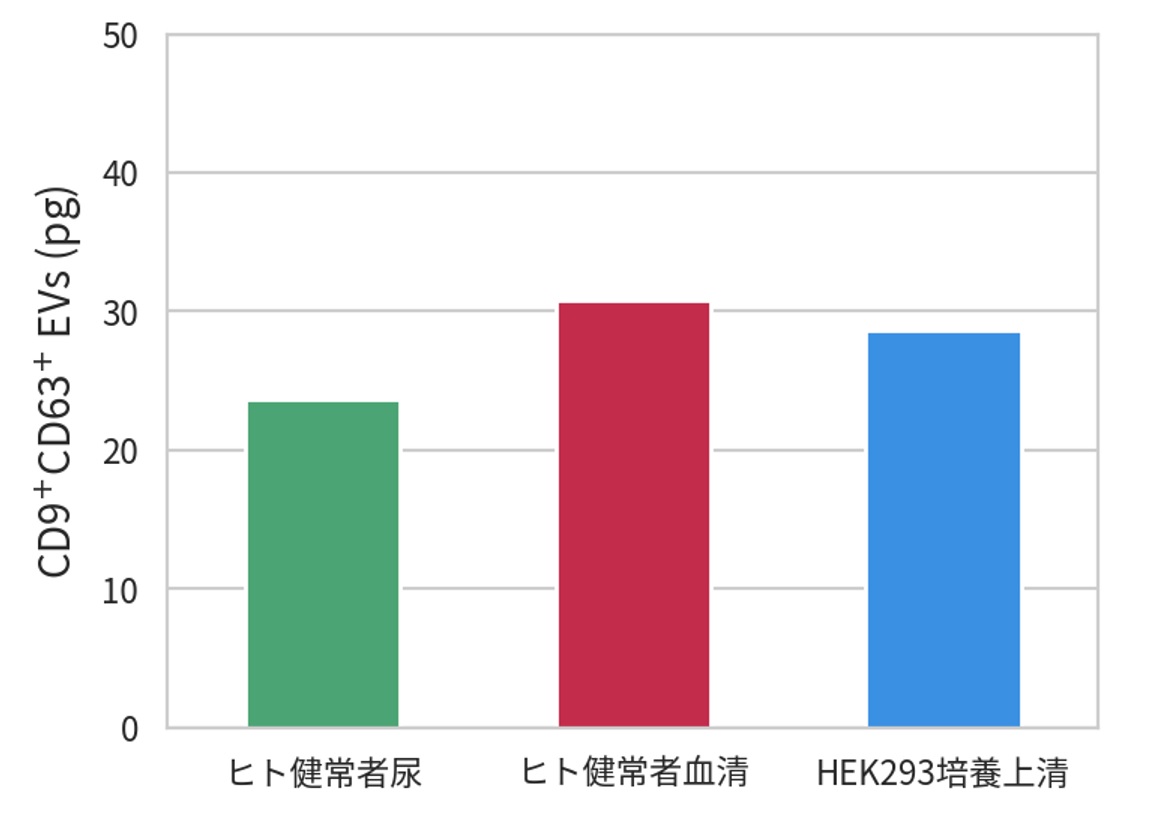
様々なサンプルからEVを回収可能です。
Western Blot

EXORPTION® –各検体からの細胞外小胞(EV)精製–
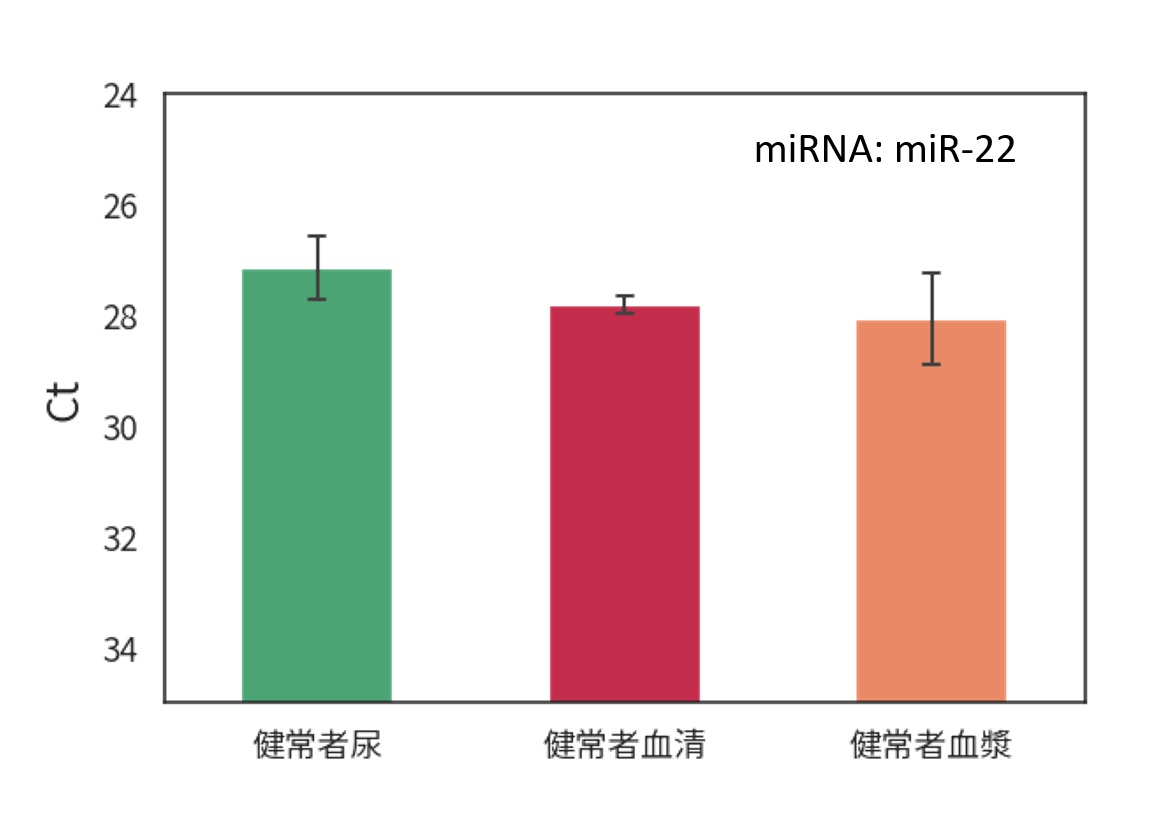
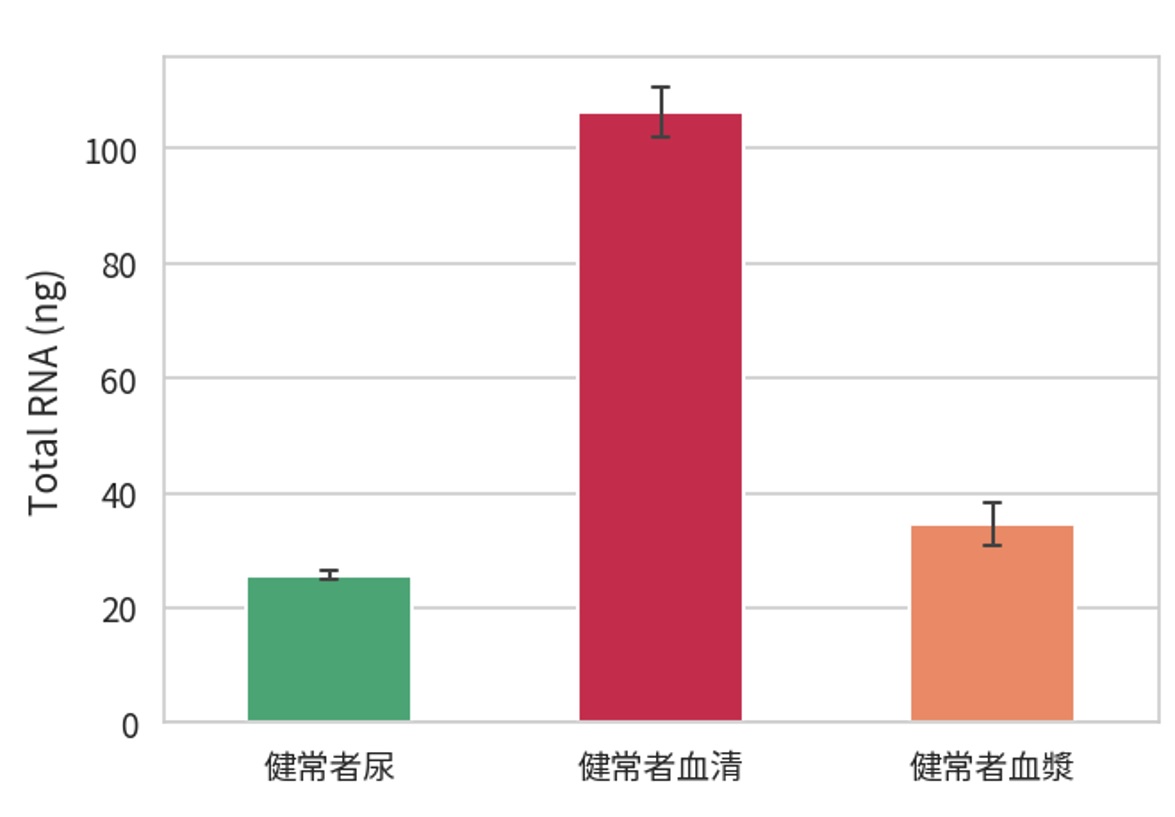
各検体から精製した細胞外小胞(EV)溶液中のRNA量を評価
精製EV中のmiRNAの存在を確認
EV中の総RNA量
RT-PCR
EXORPTION® –各検体からの細胞外小胞(EV)精製–
プロテオーム解析結果

GO enrichment 解析結果
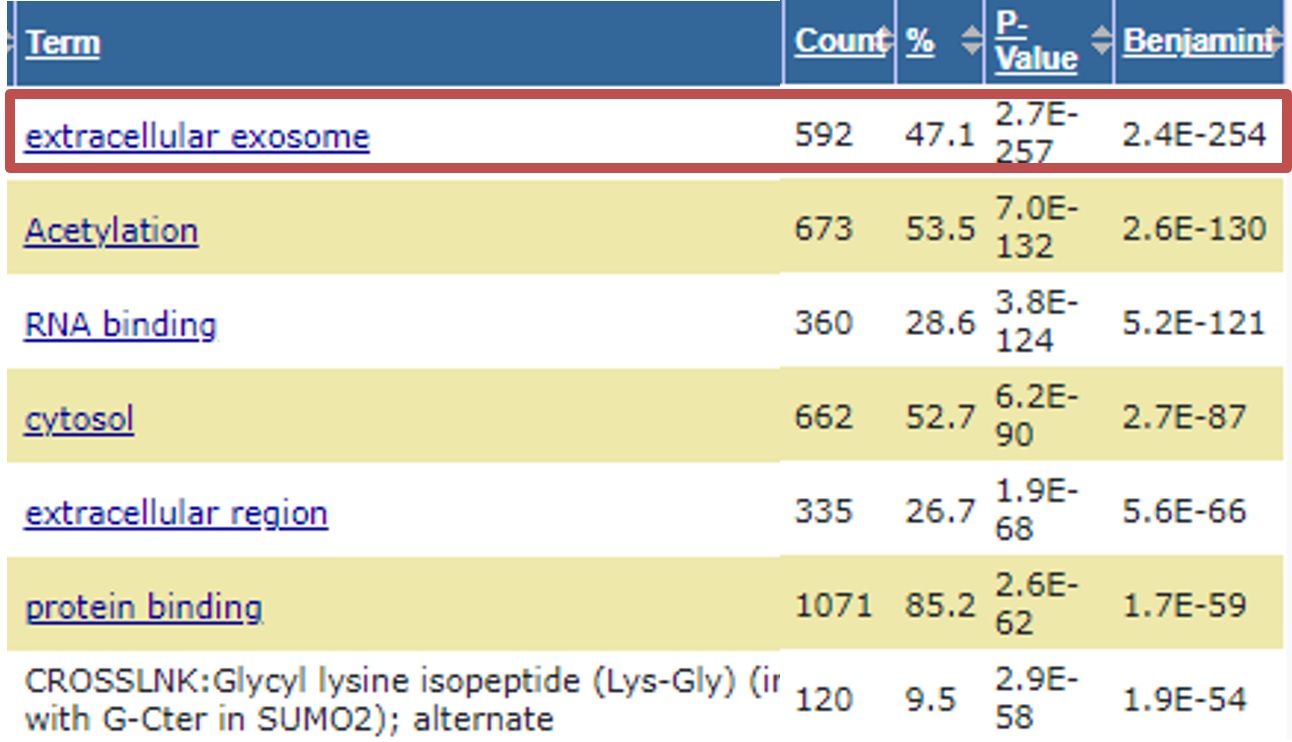
EXORPTIONで精製した細胞外小胞(EV)からEV由来のタンパク質が同定された
(例:CD9, CD63, CD81, HLA-A, HLA-B, BSG, GPC1, etc…)
EXORPTION® –シングルベシクル解析–
BD FACSymphony™ A1によりシングルベシクル解析
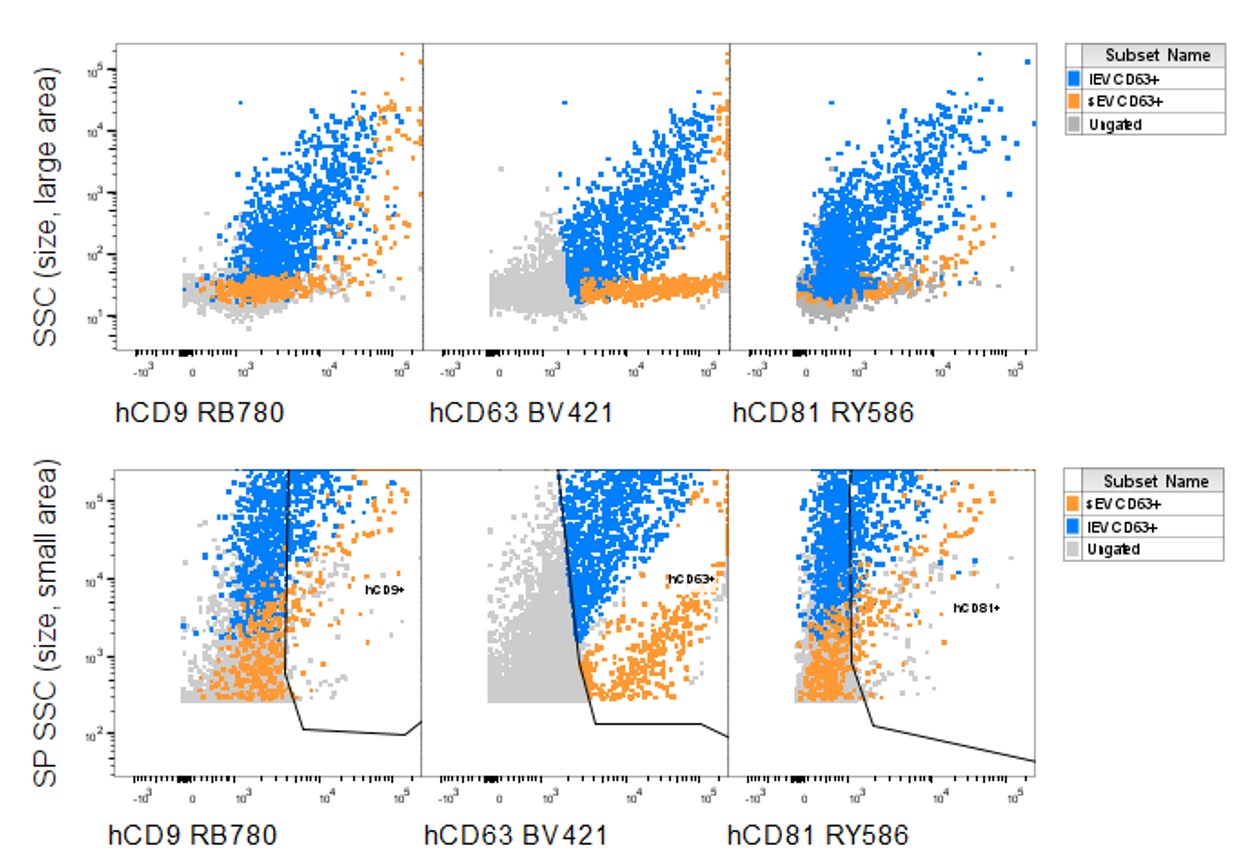
検体:ヒト健常者尿
データ提供:日本ベクトン・ディッキンソン株式会社
EXORPTION精製EVからlarge EV(lEV)とsmall EV(sEV)の両方を確認
lEV: CD9, CD63, CD81すべて陽性
sEV: CD63陽性だが、CD9,CD81は弱陽性あるいは陰性
製品紹介『EXORPTION®』

内容
Purification column 10本
LureCAP 10本
Wash Buffer (×10) 1.7mL 1本
Elution Buffer 1.7mL 1本
希釈用容器 1本
保存
室温
本製品以外に必要な器具、機器(主なもの)
マイクロピペット
ピペットチップ
2mLマイクロチューブ
卓上遠心機
冷却式遠心分離機
ボルテックスミキサー
*ピペットチップ等は低吸着グレード製品の使用を推奨します。
販売サイトへのリンク
タカラバイオEXORPTION
EXORPTION|タカラバイオ株式会社 (takara-bio.co.jp)
コスモ・バイオEXORPION
EXORPTION® 細胞外小胞(EV)精製用スピンカラムキット | 超遠心法と比較して約10倍のEV回収量 | コスモ・バイオ株式会社 (cosmobio.co.jp)
*本キットは研究用試薬のため、医療従事者・研究者を販売対象としています。
『EXORPTION®』に関するFAQ
どのようなサンプルから精製できますか?
尿・血清・唾液・細胞培養上清などから精製した実績があります。
本精製キットでの精製にかかる時間はどのくらいですか?
サンプルの吸着に30 分(静置)、洗浄操作に10 ~ 30 分、溶出に30 分(静置)の 計90 分 かかります。
サンプルの前処理は何を推奨しますか?
遠心分離等でサンプル中の夾雑物を除去したうえでキットで精製することを推奨します。
1回の精製あたりのサンプル量はどのくらいですか?
標準プロトコールでは1 mL のサンプルを精製することが可能です。サンプル量が1 mL より少ない場合は、PBS や生理食塩水等で希釈して1 mLに調製してください。また、サンプル中のEV の濃度が低い場合は最大4.6 mL までのサンプルを精製可能なプロトコールもあります。
1回の精製あたりの細胞外小胞(EV)の回収量はどのくらいですか?
サンプルの性質にも依存しますが、CD9/CD63 Exosome ELISA Kit, Human(コスモ・バイオ、品番:EXH0102EL)による定量で20~ 150 pg程度、ナノ粒子トラッキング解析(NTA)にて1010 ~ 1011 個/mLほどのEV の回収が確認されています。
本精製キットの再使用は可能ですか?
本キットの再使用はできません。
精製した細胞外小胞(EV)の利用について注意事項はありますか?
精製液に高濃度の無機塩が含まれるため、塩の存在が影響をおよぼす実験に精製したEV を使用する場合は精製液を希釈するか脱塩作業を行ってください。
一例として、この資料のデータは以下のプロトコールで測定しています。
NTA : 精製液を超純水で希釈した上で測定
ELISA : 精製液を0.2 w/v % BSA 溶液で3 ~ 5 倍希釈した上でELISA プレートに添加(CD9/CD63 Exosome ELISA Kit, Human の場合)
miRNA 解析 : 精製液をそのまま使用(Norgen 社、Exosomal RNA Isolation Kit の場合)
関連情報・トピックス
関連製品
参考文献
1)エクソソームを含む細胞外小胞(EV)を利用した治療用製剤に関する報告書
令和5年1月17日 独立行政法人医薬品医療機器総合機構 科学委員会
注意事項
ここに記載された情報は、弊社の最善の知見に基づくものですが、いかなる明示または黙示の保証をするものではありません。
①すべての化学品には未知の有害性がありうるため、取り扱いには細心の注意が必要です。本品の適性に関する決定は使用者の責任において行ってください。
②この情報は、細心の注意を払って行った試験に基づくものですが、実際の現場結果を保証するものではありません。個々の使用に対する適切な使用条件や商品の適用は、使用者の責任においてご判断ください。
③この情報は、いかなる特許の推薦やその使用を保証するものではありません。